Atomen
Lading
Atomen
Atomen zijn de bouwstoffen van de stoffen om ons heen. Er zijn meer dan 100 soorten terug te vinden in het periodiek systeem. Atomen zijn de bouwstenen van moleculen. De meest bekende zijn twee waterstof (H) atomen en één zuurstof (O) atoom die samen water ( H2O ) vormen
( Dit is de scheikundige formule voor water).
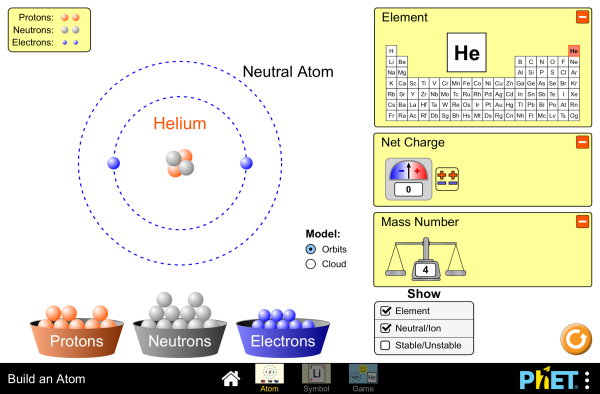
Een atoom bestaat vervolgens weer uit kleine deeltjes
De Protonen: De positieve deeltje in de kern.
De neutronen: De neutrale deeltjes in de kern om
de protonen bij elkaar te houden.
De elektronen: De negatieve deeltje die om de
kern heen draaien
Het atoom nummer is gelijk aan het aantal protonen in de kern.
Rutherford Experiment
In 1909 werden er onder leiding van Ernest Rutherford deeltjes op een dun laagje goud gevuurd. De deeltjes gingen meestal door het goud heen en werden soms een andere kant op gestuurd. De conclusie was dat goud (en alle andere atomen) voor het grootste deel leeg zijn. Slechts op een paar plekken zitten deeltjes die voor een botsing zorgen.
Protonen positief geladen deeltjes in de kern.
Het aantal protonen bepaald het soort atoom. Het atoom nummer is gelijk aan het aantal protonen.
Elektronen negatief geladen deeltje die bewegen rond de kern als de aarde om de zon.
Vrije elektron een negatief deeltje dat zich kan verplaatsen van atoom naar atoom.
Aantrekkingskracht
Deeltjes met een verschillende lading trekken elkaar aan.
Afstoten
Deeltjes met dezelfde lading stoten elkaar af.


Neutraal geladen
Normaal zit er altijd even veel protonen als neutronen in de kern. Het atoom is dan neutraal geladen.
Positief geladen
Protonen kunnen zich niet verplaatsten. Het aantal positieve deeltjes in de kern blijft gelijk. De positieve lading ontstaat door een tekort aan elektronen in het atoom.
Negatieve geladen
In tegenstelling tot een positief geladen atoom heeft een negatief geladen atoom teveel aan elektronen.
Elektrische lading.
Een elektrische lading ontstaat doordat er aan een kant elektronen tekort zijn (de plus) en aan de andere kant elektronen teveel zijn (de min)